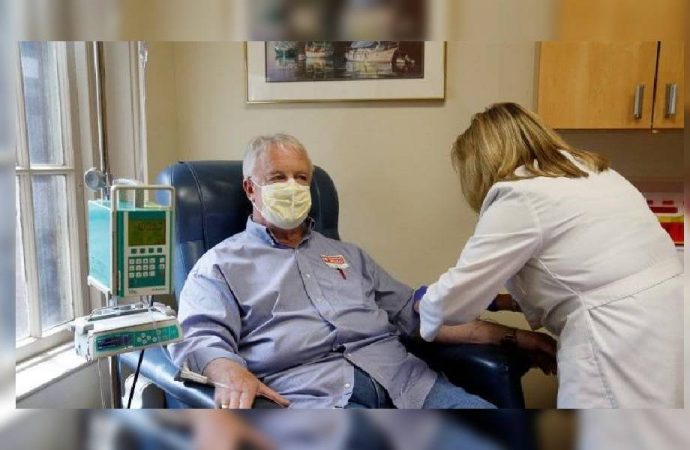
Brown Üniversitesi Tıp Fakültesi Nöroloji Profesörü Dr. Stephen Salloway yaptığı açıklamada, Butler Hastanesi programında, aylık intravenöz infüzyon olarak verilen ilaca iyi aday olabilecek yaklaşık 100 hasta olduğunu belirterek, “Tedavide yeni bir dönem açıyoruz. Umarım klinisyenler klinik deney kılavuzlarına uyacaklardır, çünkü daha ileri Alzheimer hastaları için gerçekten herhangi bir bulgumuz yok” ifadelerini kullandı.
FDA’DAN 20 YILIN ARDINDAN İLK KEZ YENİ BİR ALZHEIMER İLACINA ONAY
FDA, 20 yıl sonra ilk kez yeni bir Alzheimer ilacına onay vermiş, söz konusu ilacın, anksiyete ve uykusuzluk gibi semptomları yönetmek yerine, altta yatan hastalığı tedavi edebileceği tek ilaç olduğunu kaydetmişti. FDA, her 4 haftada bir infüzyon olarak verilen ilacın bunamayı tersine çevirmediğini, sadece yavaşlattığını belirtmişti.
İLACIN YÜKSEK FİYATI DA TEPKİLERİN ODAĞINDA
Aducanumab’ın yaklaşık fiyatının belirlenmesinin ardından Biogen’in uzun zamandır açık sözlü bir destekçisi ABD Alzheimer Derneği’nden tepki gecikmemişti. Biogen ve Eisai tarafından 7 Haziran tarihinde yapılan açıklamada, Aducanumab’ın yıllık tedavi ücretinin yaklaşık 56 bin dolar olduğu kaydedilmişti. İlacın yüksek fiyatına ilişkin tepki gösteren ABD Alzheimer Derneği tarafından 12 Haziran tarihinde yapılan açıklamada, “Kısaca kabul edilemez” ifadelerini kullanılmıştı.
İlacın uygulanacağı hastaların büyük çoğunluğunun federal Medicare sağlık programı kapsamında olacağı belirtilirken, Alzheimer Derneği’nin Kamu Politikası Başkanı Robert Egge yaptığı açıklamada, Medicare alıcılarının çoğunun doktorlar tarafından verilen ilaçların maliyetinin yüzde 20’sinden sorumlu olduğunu ve bunların yaklaşık yüzde 10’unun bu maliyetler üzerinde herhangi bir üst sınırı olmadığını ifade etmişti. Egge, “Bu, ülke genelinde yaşadığımız sağlık eşitliği zorluklarını daha da kötüleştirebilir” demişti.
ETKİNLİK GÖSTERMEZSE PİYASADAN ÇEKİLECEK
FDA’nın hızlandırılmış onayı şartlarına göre, ilaç üreticisinin tedavilerin klinik yararı olduğunu doğrulamak için 4. faz doğrulayıcı denemeler olarak bilinen “onay sonrası çalışmaları” yürütmesi şart koşulurken, Aducanumab üzerinde çalışmalar ise devam edecek. Çalışmalardan elde edilen sonuçların, ilacın etkinliği gösterememesi halinde FDA, nadiren alınan bir karar olsa da, ilacı piyasadan geri çekebilir.

 kanalımıza katılın
kanalımıza katılın